Medical Device Single Audit Program
Medical Device Single Audit Program


Cos'è un audit MDSAP?
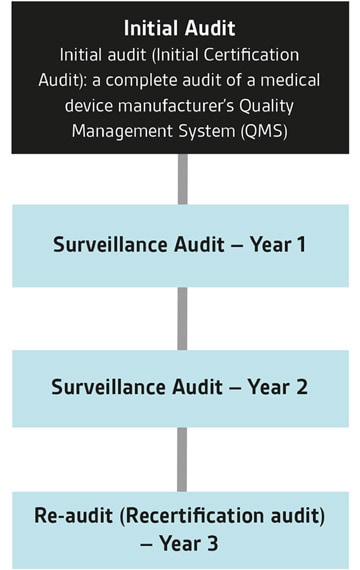
Attraverso MDSAP i produttori di dispositivi medici possono essere sottoposti a un unico audit per verificare la conformità agli standard e ai requisiti normativi di un massimo di cinque diversi mercati di dispositivi medici.
Questi paesi sono Australia, Brasile, Canada, Giappone e Stati Uniti. Gli audit MDSAP possono essere eseguiti da AO (Auditing Organizations) riconosciute, come BSI, autorizzate dalle Autorità Regolatorie (RA) MDSAP. BSI è un Auditing Organization per MDSAP. BSI offre MDSAP anche in combinazione con le valutazioni CE, UKCA, ISO 13485 e ISO 9001. Siamo attivi sin dalla fase pilota iniziale di MDSAP e abbiamo già completato un numero significativo di audit MDSAP, soprattutto per produttori di dispositivi medici e PMI leader a livello mondiale.
Risorse chiave per aiutarti con MDSAP
Scopri di più su Medical Device Single Audit Progam.
-
Brochure: MDSAP Global Market Access >
MDSAP è una possibilità attraverso la quale i produttori di dispositivi medici possono essere sottoposti a un unico audit per verificare la conformità agli standard e ai requisiti normativi di un massimo di cinque diversi mercati di dispositivi medici.
-
Training: Fundamentals and Readiness Course >
Learn more about our training courses, available dates and booking options
-

Webinar: Are you ready for the Medical Device Single Audit Program (MDSAP)? >
Offriamo un'ampia gamma di webinar gratuiti e dal vivo tenuti da Technical Specialist BSI che affrontano argomenti chiave che riguardano la vostra attività, tra cui la legislazione, i rischi e le modifiche normative.
-

Whitepaper: Responsibilities for Medical Device Vigilance Reporting >
I nostri white paper ti aiuteranno a capire come migliorare le prestazioni, ridurre i rischi e rendere l'eccellenza un'abitudine nella vostra organizzazione.